原子の構造(電子配列について)
原子核、電子軌道のエネルギー遷移について、まず原子の構造(電子配列)について説明を行う。
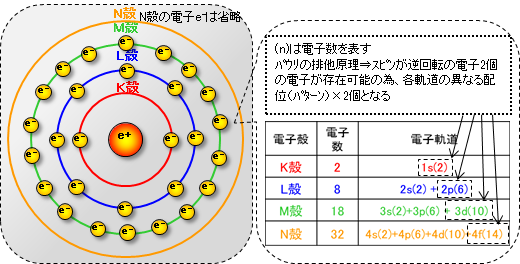
下図に示すように原子核の周りには電子軌道がある。この電子軌道には内側からK殻、L殻、M殻、N殻、・・・と呼ばれる軌道の種類があり、それぞれの殻に入る電子の最大数は決まっている。
※電子軌道については実際は図に示すような円を描く軌道ではなく量子力学に基づきその順位レベルに電子が存在する確率が高いことを表している雲状のようなものであり、電子そのもの位置を特定することはできない。
電子軌道について
電子殻の他に電子の軌道の形が違う幾つかのパターンがある。これは電子が原子核を中心として運動している軌道(配置、分布)の事であり電子軌道と呼ばれ、上図に示すような幾つかの軌道に区分される。 (シュレディンガーの波動方程式)
s軌道;
各電子殻に1つづつ存在原子核を中心の球状に電子が分布される軌道 (1s、2s、3s、・・・)1つのs軌道には、電子の回転が逆の場合も合わせ2個まで電子が存在 できる。(パウリの排他律)
p軌道;
L殻以降に存在し、原子核を中心に8の字状(瓢箪状)に分布する軌道(2p、3p、 ・・・)X、Y、Z軸方向に3つの配位の軌道が存在し、電子の逆回転も合わせ最大6個まで電子が存在できる。